Proteínas: Função, tipos, estrutura, importância – Resumo
As proteínas são os blocos de construção da vida. Eles são vitais para a nossa existência e são encontrados em todos os organismos da Terra. As proteínas são as moléculas mais comuns encontradas nas células . Na verdade, eles constituem mais matéria seca de uma célula do que lipídios , carboidratos e todas as outras moléculas combinadas.
O que vamos ver
- A importância das proteínas
- Diferentes funções das proteínas dentro do corpo
- O significado dos aminoácidos como os blocos de construção das proteínas
- O que é uma cadeia polipeptídica e como ela é formada
- Os quatro níveis de estrutura para proteínas
- Os diferentes tipos de proteínas e como eles diferem
Uma proteína é produzida a partir de uma ou mais cadeias polipeptídicas e cada cadeia polipeptídica é construída a partir de moléculas menores chamadas ‘aminoácidos’. Há um total de 20 aminoácidos que podem ser dispostos em trilhões e trilhões de maneiras diferentes para criar proteínas que atendem a uma enorme variedade de funções.
As proteínas são, de fato, as moléculas estruturalmente mais complexas conhecidas pela biologia.
FUNÇÕES DE PROTEÍNAS
Proteínas vêm em uma enorme variedade de formas e executam uma ampla gama de funções. Exemplos de proteínas incluem enzimas, anticorpos e alguns hormônios que ajudam a acelerar reações químicas, defender-se de doenças e regular a atividade das células .
As proteínas também desempenham um papel no movimento, suporte estrutural, armazenamento, comunicação entre as células, digestão e transporte de substâncias ao redor do corpo.
MOVIMENTO
Proteínas motoras, como miosina e dineínas, têm a capacidade de converter energia química em movimento. A miosina é a proteína encontrada no músculo e causa a contração das fibras musculares nos músculos.
Dineínas fornecem o poder que impulsiona flagelos . Os flagelos são estruturas longas e finas ligadas ao exterior de certas células, como os espermatozoides, e são responsáveis pela sua mobilidade.
ESTRUTURA E SUPORTE
Muitas proteínas fornecem suporte estrutural a partes específicas de um organismo. Queratina, por exemplo, é a proteína encontrada nas camadas externas da pele e torna a pele uma forte camada protetora para o mundo exterior. A queratina também é a proteína estrutural que produz cabelos, chifres e unhas.
COMUNICAÇÃO CELULAR
As células se comunicam com o meio ambiente e outras células. As proteínas receptoras na membrana de uma célula recebem sinais de fora da célula e transmitem mensagens para a célula. Uma vez que o sinal esteja dentro da célula, ele geralmente é passado entre um número de proteínas antes de chegar ao seu destino final (também mais comumente uma proteína).
Veja também:
- A Água – características físicas e químicas – Resumo
- Moléculas Biológicas – Tipos, funções – Resumo
- As Moléculas da vida
- Carboidratos: tipos, função, estrutura – Sacarídeos
- Proteínas – Função, tipos, estrutura, importância – Resumo
- O que são Lipídeos – Função, estrutura, importância – Resumo
DIGESTÃO
Digestão é impulsionada por, você adivinhou, proteínas. Enzimas são proteínas que impulsionam a digestão acelerando as reações químicas.
A digestão é a quebra de alimentos de moléculas grandes e insolúveis em moléculas menores que podem se dissolver em água. Como as moléculas menores são solúveis em água, elas podem entrar no sangue e ser transportadas pelo corpo.
As enzimas digestivas são as enzimas responsáveis por decompor as moléculas dos alimentos em moléculas menores e solúveis em água. Alguns exemplos de proteínas digestivas incluem:
- Amilase – a enzima na saliva que decompõe o amido em açúcares solúveis
- Lipase – quebra gorduras e outros lipídios
- Pepsina – decompõe proteínas em comida
TRANSPORTE DE OXIGÊNIO
A hemoglobina é outra proteína extremamente importante para animais, como mamíferos e aves . É a proteína no sangue que se liga ao oxigênio para que o oxigênio possa ser transportado pelo corpo.
A hemoglobina contém um átomo de ferro. A estrutura química da hemoglobina em torno do átomo de ferro permite que o oxigênio se ligue ao ferro e seja liberado para o tecido privado de oxigênio.
Como você pode ver, as proteínas são claramente extremamente importantes para o funcionamento saudável de um organismo. A maioria dos exemplos que utilizei são proteínas animais, mas as proteínas não são menos importantes para outras formas de vida, como plantas, fungos e bactérias .
BLOCOS DE CONSTRUÇÃO DE PROTEÍNAS
Os aminoácidos são os blocos de construção das proteínas. No total, existem 20 aminoácidos diferentes encontrados na natureza. Os aminoácidos podem se unir em uma enorme variedade de maneiras de criar proteínas diferentes.
A estrutura química dos aminoácidos é a chave para as proteínas se tornarem a base da vida. Um aminoácido consiste de um grupo carboxila (estrutura química -COOH), um grupo amina (-NH₂) e uma cadeia lateral feita principalmente de carbono e hidrogênio.
A sidechain é frequentemente referida como o grupo R. Diferenças no grupo R é o que faz os 20 aminoácidos diferentes um do outro.
Dependendo da estrutura do grupo R, um aminoácido pode ser solúvel em água (polar), insolúvel em água (não polar) ou conter uma carga positiva ou negativa. Essas características, por sua vez, afetam a maneira como os aminoácidos se comportam quando se ligam e influenciam a forma e a função geral de uma proteína.
Todos os 20 aminoácidos são necessários para uma boa saúde. Se um organismo é baixo em um dos 20 aminoácidos, certas proteínas não serão capazes de ser construídas e a perda de suas funções causará problemas de saúde para o organismo.
Alguns aminoácidos podem ser criados pelo corpo usando outras moléculas, enquanto outros aminoácidos devem ser provenientes de alimentos. Os aminoácidos que devem ser ingeridos são conhecidos como “aminoácidos essenciais” porque são parte essencial de uma dieta saudável. Os aminoácidos que podem ser produzidos pelos nossos corpos são conhecidos como “aminoácidos não essenciais”.
POLIPEPTÍDEOS
Um polipeptídeo é uma cadeia de aminoácidos e é a forma mais simples de uma proteína. Os aminoácidos se unem para formar cadeias lineares longas que podem ter mais de 2000 aminoácidos de comprimento.
A ordem em que os aminoácidos estão ligados determina a forma final e a estrutura da cadeia polipeptídica. Uma proteína conterá um polipéptido ou múltiplos polipéptidos ligados entre si para formar proteínas grandes e complexas.
Os aminoácidos estão ligados entre o grupo amina (-NH2) de um aminoácido e o grupo carboxilo (-COOH) de um segundo aminoácido.
À medida que dois aminoácidos se ligam, dois íons de hidrogênio são removidos do grupo amina e um oxigênio é removido do grupo carboxila. O grupo amina e a ligação do grupo carboxilo em conjunto e uma molécula de água são produzidos como um subproduto. A ligação é conhecida como uma ligação peptídica.
A ligação de múltiplos aminoácidos em conjunto por ligações peptídicas cria um esqueleto polipeptídico com um grupo R que se estende para fora de cada aminoácido. Como mencionado anteriormente, os grupos R dos 20 aminoácidos têm sua própria estrutura e propriedades químicas. A estrutura e as propriedades químicas (tais como a reatividade e a temperatura de ebulição) de um polipéptido e finalmente uma proteína são determinadas pela sequência única de grupos R que se prolongam a partir do esqueleto polipeptídico. À medida que os grupos R são atraídos ou repelidos um do outro, a cadeia polipeptídica se dobra e se transforma em uma proteína de formato único.
ESTRUTURA PROTEICA
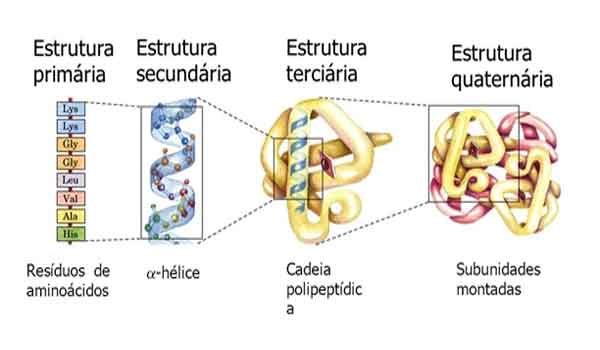
As proteínas têm quatro níveis de estrutura, os quais já aludimos nesta página. Os quatro níveis são conhecidos como a estrutura primária, secundária, terciária e quaternária de uma proteína.
ESTRUTURA PRIMÁRIA
A estrutura primária é a seqüência específica de aminoácidos, ou seja, a ordem em que eles estão ligados. A ordem exata em que os aminoácidos são ligados é determinada pela informação armazenada nos genes .
Através de processos chamados transcrição e tradução , o DNA fornece todas as informações necessárias para as células produzirem a estrutura primária exata para milhares de proteínas diferentes. A estrutura primária determina as estruturas secundárias e terciárias das proteínas.
ESTRUTURA SECUNDÁRIA
A estrutura secundária de uma proteína é formada por ligações de hidrogênio entre os átomos ao longo da cadeia principal da cadeia polipeptídica.
Lembrando que cada aminoácido possui um grupo carboxila e um grupo amina, a ligeira carga negativa no oxigênio do grupo carboxila forma uma ligação fraca com a ligeira carga positiva de um átomo de hidrogênio no grupo amina de outro aminoácido. As ligações de hidrogênio são fracas, mas muitas delas criam força suficiente para influenciar a forma de uma cadeia polipeptídica.
As ligações de hidrogénio fazem com que o esqueleto do polipéptido se dobre e enrole em duas formas possíveis – a hélice α e as folhas plissadas β. Uma hélice α (letra grega ‘alpha’) é uma espiral, semelhante à hélice dupla da fita de DNA icônica, mas com apenas uma bobina, e é formada por ligações de hidrogênio entre cada quarto aminoácido. A hélice α é comum em proteínas estruturais como a queratina.
As folhas pregueadas de β (letra grega ‘beta’) são formadas quando ligações de hidrogênio ocorrem entre duas ou mais cadeias polipeptídicas adjacentes e são comuns em proteínas globulares (veja abaixo em ‘Tipos de proteínas’).
ESTRUTURA TERCIÁRIA
A estrutura terciária é a forma final que a cadeia polipeptídica assume e é determinada pelos grupos R. A atração e repulsão entre diferentes grupos R dobra e dobra o polipeptídeo para criar a forma 3D final de uma proteína.
ESTRUTURA QUATERNÁRIA
Nem todas as proteínas possuem uma estrutura quaternária. Uma estrutura quaternária só resulta quando múltiplas cadeias polipeptídicas se combinam para formar uma proteína complexa grande. Em tais casos, cada polipeptídeo é referido como uma ‘subunidade’.
A hemoglobina é um exemplo de uma proteína com estrutura quaternária. Na maioria dos animais, a hemoglobina é composta por quatro subunidades globulares.
TIPOS DE PROTEÍNAS
Existem quatro tipos principais de proteínas. Os mais comumente conhecidos são as proteínas globulares. Os outros três tipos de proteínas são fibrosas, membranares e desordenadas.
PROTEÍNAS GLOBULARES
Uma proteína globular é qualquer proteína que assume uma forma esférica em sua estrutura terciária. Estes incluem muitas enzimas, anticorpos e proteínas, como a hemoglobina.
As proteínas globulares são solúveis em água e são criadas devido à atração e repulsão de diferentes grupos R com água. Os grupos polares R dos aminoácidos nas proteínas são solúveis em água, enquanto os grupos R não polares são insolúveis em água. As proteínas globulares se formam porque os grupos R não polares se escondem nas seções internas da proteína e nos grupos R polares que se organizam na superfície externa que é exposta a qualquer água circundante.
PROTEÍNAS FIBROSAS
Proteínas fibrosas são proteínas alongadas que não possuem estrutura terciária. Em vez de dobrar e dobrar para formar uma proteína globular, as proteínas fibrosas permanecem em sua estrutura secundária linear. São frequentemente importantes proteínas estruturais e de suporte.
As proteínas fibrosas são insolúveis em água e freqüentemente apresentam padrões repetitivos de aminoácidos ao longo de sua cadeia polipeptídica. Exemplos de proteínas fibrosas incluem colagénio, queratina e seda.
PROTEÍNAS DE MEMBRANA
Uma proteína de membrana é qualquer proteína encontrada dentro ou ligada a uma membrana celular. Eles são proteínas únicas devido ao ambiente único em que elas existem.
As membranas celulares são feitas de uma dupla camada de fosfolipídios. As partes internas de uma membrana celular são não polares, mas o exterior é polar. Para que as proteínas de membrana existam com sucesso através de uma membrana celular, elas devem conter seções polares e não polares específicas.
PROTEÍNAS DESORDENADAS
A descoberta de proteínas desordenadas no início dos anos 2000 desafiou o pensamento histórico das proteínas. Até então, acreditava-se que a função de uma proteína dependia de sua estrutura 3D fixa. No entanto, as proteínas desordenadas não exibem nenhuma estrutura ordenada em sua forma.
Algumas proteínas podem ser totalmente desestruturadas, enquanto outras são parcialmente estruturadas com certas seções não estruturadas. Outras proteínas têm a capacidade de existir como proteínas desordenadas apenas para formar uma estrutura fixa após a ligação a outras moléculas.