O que é metabolismo – anabolismo, catabolismo e energia
Os cientistas usam o termo bioenergética para descrever o conceito de fluxo de energia ( Figura ) através de sistemas vivos, como as células. Processos celulares, como a construção e a quebra de moléculas complexas, ocorrem através de reações químicas graduais. Algumas dessas reações químicas são espontâneas e liberam energia, enquanto outras requerem energia para prosseguir. Assim como as coisas vivas precisam consumir continuamente alimentos para reabastecer seu suprimento de energia, as células precisam continuamente produzir mais energia para repor o que é usado pelas muitas reações químicas que exigem energia e que ocorrem constantemente. Juntas, todas as reações químicas que ocorrem dentro das células, incluindo aquelas que consomem ou geram energia, são referidas como o metabolismo da célula .

Vias metabólicas
Considere o metabolismo do açúcar. Este é um exemplo clássico de um dos muitos processos celulares que usam e produzem energia. As coisas vivas consomem açúcares como uma importante fonte de energia, porque as moléculas de açúcar têm uma grande quantidade de energia armazenada dentro de suas ligações. Na maior parte, organismos fotossintetizantes como plantas produzem esses açúcares.
Durante a fotossíntese, as plantas usam energia (originalmente da luz solar) para converter gás de dióxido de carbono (CO 2 ) em moléculas de açúcar (como a glicose: C 6 H 12 O 6 ). Eles consomem dióxido de carbono e produzem oxigênio como um produto residual. Esta reação é resumida como:
6CO2+6H2O−−>C6H12O6+6O2
Como esse processo envolve a síntese de uma molécula armazenadora de energia, ela requer a entrada de energia para prosseguir. Durante as reações de luz da fotossíntese, a energia é fornecida por uma molécula chamada trifosfato de adenosina (ATP), que é a moeda de energia primária de todas as células. Assim como o dólar é usado como moeda para comprar bens, as células usam moléculas de ATP como moeda de energia para realizar o trabalho imediato.
Em contraste, as moléculas de armazenamento de energia, como a glicose, são consumidas apenas para serem decompostas para usar sua energia. A reação que colhe a energia de uma molécula de açúcar nas células que necessitam de oxigênio para sobreviver pode ser resumida pela reação inversa à fotossíntese. Nesta reação, o oxigênio é consumido e o dióxido de carbono é liberado como um produto residual. A reação é resumida como:
Ambas as reações envolvem muitos passos.
Os processos de fabricação e quebra de moléculas de açúcar ilustram dois exemplos de vias metabólicas. Uma via metabólica é uma série de reações químicas que toma uma molécula inicial e a modifica, passo a passo, através de uma série de intermediários metabólicos, eventualmente produzindo um produto final. No exemplo do metabolismo do açúcar, a primeira via metabólica sintetizava açúcar a partir de moléculas menores e a outra via quebrava o açúcar em moléculas menores.
Esses dois processos opostos – o primeiro exigindo energia e o segundo produzindo energia – são referidos como vias anabólicas (polímeros prediais) e vias catabólicas (decompondo polímeros em seus monômeros), respectivamente. Consequentemente, o metabolismo é composto de síntese (anabolismo) e degradação (catabolismo) (Figura ).
É importante saber que as reações químicas das vias metabólicas não ocorrem sozinhas. Cada etapa da reação é facilitada ou catalisada por uma proteína chamada enzima. As enzimas são importantes para catalisar todos os tipos de reações biológicas – aquelas que requerem energia, bem como aquelas que liberam energia.

- Ciclo de Calvin Benson: o que é, como ocorre, função – Resumo
- A importância da luz para o seres vivos
- Principais vias metabólicas
- Fotossíntese: o que é, como ocorre, processo, equação – Resumo
- Ciclo do ácido cítrico: o que é, fases – resumo
- Fermentação: o que é, tipos, etapas, processos – Resumo
- Glicólise: o que é, processos, função – Resumo
- O que é metabolismo – anabolismo, catabolismo e energia
- Transporte Ativo: tipos, função, exemplos – Resumo
- Transporte passivo: tipos, função – Resumo
Energia
Termodinâmica refere-se ao estudo da energia e transferência de energia envolvendo matéria física. O assunto relevante para um caso particular de transferência de energia é chamado de sistema, e tudo fora desse assunto é chamado de ambiente. Por exemplo, ao aquecer uma panela de água no fogão, o sistema inclui o fogão, a panela e a água. A energia é transferida dentro do sistema (entre o fogão, a panela e a água).
Existem dois tipos de sistemas: aberto e fechado. Em um sistema aberto, a energia pode ser trocada com o ambiente. O sistema de fogão está aberto porque o calor pode ser perdido para o ar. Um sistema fechado não pode trocar energia com o ambiente.
Organismos biológicos são sistemas abertos. A energia é trocada entre eles e seus arredores à medida que eles usam energia do sol para realizar a fotossíntese ou consomem moléculas armazenadoras de energia e liberam energia para o meio ambiente realizando trabalho e liberando calor. Como todas as coisas no mundo físico, a energia está sujeita às leis físicas. As leis da termodinâmica governam a transferência de energia em e entre todos os sistemas do universo.
Em geral, energia é definida como a capacidade de realizar trabalho ou criar algum tipo de mudança. A energia existe em diferentes formas. Por exemplo, energia elétrica, energia luminosa e energia térmica são todos tipos diferentes de energia. Para apreciar a maneira pela qual a energia entra e sai dos sistemas biológicos, é importante entender duas das leis físicas que governam a energia.
Termodinâmica
A primeira lei da termodinâmica afirma que a quantidade total de energia no universo é constante e conservada. Em outras palavras, sempre houve e sempre haverá exatamente a mesma quantidade de energia no universo.
A energia existe em muitas formas diferentes. De acordo com a primeira lei da termodinâmica, a energia pode ser transferida de um lugar para outro ou transformada em diferentes formas, mas não pode ser criada ou destruída. As transferências e transformações de energia acontecem ao nosso redor o tempo todo. As lâmpadas transformam energia elétrica em luz e energia térmica.
Os fogões a gás transformam a energia química do gás natural em energia térmica. Plantas executar um dos mais biologicamente útil transformações de energia na terra: o de converter a energia da luz solar em energia química armazenada dentro de moléculas orgânicas ( Figura). Alguns exemplos de transformações de energia são mostrados na figura .
O desafio para todos os organismos vivos é obter energia de seus arredores em formas que eles possam transferir ou transformar em energia utilizável para realizar o trabalho. As células vivas evoluíram para enfrentar esse desafio.
A energia química armazenada em moléculas orgânicas, como açúcares e gorduras, é transferida e transformada através de uma série de reações químicas celulares em energia dentro de moléculas de ATP. Energia nas moléculas de ATP é facilmente acessível para fazer o trabalho. Exemplos dos tipos de trabalho que as células precisam fazer incluem construir moléculas complexas, transportar materiais, alimentar o movimento de cílios ou flagelos e contrair fibras musculares para criar movimento.

As principais tarefas da célula viva de obter, transformar e usar energia para fazer o trabalho podem parecer simples. No entanto, a segunda lei da termodinâmica explica por que essas tarefas são mais difíceis do que parecem. Todas as transferências e transformações de energia nunca são completamente eficientes. Em toda transferência de energia, alguma quantidade de energia é perdida de uma forma inutilizável. Na maioria dos casos, essa forma é energia térmica.
Termodinamicamente, a energia térmica é definida como a energia transferida de um sistema para outro que não é trabalho. Por exemplo, quando uma lâmpada é ligada, parte da energia que está sendo convertida de energia elétrica em energia luminosa é perdida como energia térmica. Da mesma forma, alguma energia é perdida como energia de calor durante as reações metabólicas celulares.
Um conceito importante nos sistemas físicos é o da ordem e da desordem. Quanto mais energia é perdida por um sistema em seu entorno, menos ordenado e mais aleatório é o sistema. Os cientistas referem-se à medida de aleatoriedade ou desordem dentro de um sistema como entropia.
Entropia alta significa desordem alta e baixa energia. Moléculas e reações químicas têm entropia variada também. Por exemplo, a entropia aumenta à medida que moléculas em alta concentração em um lugar se difundem e se espalham. A segunda lei da termodinâmica diz que a energia sempre será perdida como calor nas transferências ou transformações de energia.
As coisas vivas são altamente ordenadas, exigindo constante entrada de energia para serem mantidas em um estado de baixa entropia.
Energia Potencial e Cinética
Quando um objeto está em movimento, há energia associada a esse objeto. Pense em uma bola de demolição. Mesmo uma bola de demolição lenta pode causar muitos danos a outros objetos. A energia associada aos objetos em movimento é chamada de energia cinética ( figura ). Uma bala em alta velocidade, uma pessoa que anda e o movimento rápido de moléculas no ar (que produz calor) têm energia cinética.
Agora, e se essa mesma bola de demolição imóvel for levantada dois andares acima do solo com um guindaste? Se a bola de demolição suspensa estiver imóvel, há energia associada a ela? A resposta é sim. A energia necessária para levantar a bola de demolição não desapareceu, mas agora está armazenada na bola de demolição em virtude de sua posição e da força da gravidade atuando sobre ela. Este tipo de energia é chamado energia potencial ( Figura).
Se a bola caísse, a energia potencial seria transformada em energia cinética até que toda a energia potencial estivesse esgotada quando a bola pousasse no chão. Bolas de demolição também balançam como um pêndulo; através do balanço, há uma mudança constante de energia potencial (mais alta no topo do balanço) para energia cinética (mais alta na parte inferior do balanço). Outros exemplos de energia potencial incluem a energia da água mantida atrás de uma represa ou uma pessoa prestes a saltar de um avião.

A energia potencial não está associada apenas à localização da matéria, mas também à estrutura da matéria. Mesmo uma mola no solo tem energia potencial se for comprimida; o mesmo acontece com um elástico que é esticado.
Em um nível molecular, as ligações que mantêm os átomos das moléculas juntas existem em uma estrutura particular que possui energia potencial. Lembre-se de que as vias celulares anabólicas requerem energia para sintetizar moléculas complexas das mais simples e as vias catabólicas liberam energia quando moléculas complexas são quebradas. O fato de que a energia pode ser liberada pela quebra de certas ligações químicas implica que essas ligações têm energia potencial.
De fato, há energia potencial armazenada nas ligações de todas as moléculas de alimentos que comemos, que eventualmente é aproveitada para uso. Isso ocorre porque esses laços podem liberar energia quando quebrados. O tipo de energia potencial existente nas ligações químicas e liberado quando essas ligações são quebradas é chamado de energia química. A energia química é responsável por fornecer às células vivas energia dos alimentos. A liberação de energia ocorre quando as ligações moleculares dentro das moléculas dos alimentos são quebradas.
Energia Livre e Energia de Ativação
Depois de saber que as reações químicas liberam energia quando se quebram os laços que armazenam energia, uma próxima pergunta importante é a seguinte: Como a energia associada a essas reações químicas é quantificada e expressa? Como a energia liberada de uma reação pode ser comparada à de outra reação? Uma medida de energia livre é usada para quantificar essas transferências de energia.
Lembre-se de que, de acordo com a segunda lei da termodinâmica, todas as transferências de energia envolvem a perda de alguma quantidade de energia de uma forma inutilizável, como o calor. Energia livre refere-se especificamente à energia associada a uma reação química que está disponível após as perdas serem contabilizadas. Em outras palavras, energia livre é energia utilizável, ou energia que está disponível para fazer o trabalho.
Se a energia é liberada durante uma reação química, então a mudança na energia livre, significada como ∆G (delta G), será um número negativo. Uma mudança negativa na energia livre também significa que os produtos da reação têm menos energia livre que os reagentes, porque liberam energia livre durante a reação. Reações que têm uma mudança negativa na energia livre e, consequentemente, liberam energia livre são chamadas de reações exergônicas . Pense: ex ergônico significa que a energia é exo sistema. Essas reações também são chamadas de reações espontâneas, e seus produtos têm menos energia armazenada que os reagentes.
Uma distinção importante deve ser feita entre o termo espontâneo e a idéia de uma reação química ocorrendo imediatamente. Ao contrário do uso cotidiano do termo, uma reação espontânea não é aquela que repentina ou rapidamente ocorre. A ferrugem do ferro é um exemplo de uma reação espontânea que ocorre lentamente, pouco a pouco, com o passar do tempo.
Se uma reação química absorve energia ao invés de liberar energia em equilíbrio, então o forG para essa reação será um valor positivo. Neste caso, os produtos têm mais energia livre que os reagentes. Assim, os produtos dessas reações podem ser pensados como moléculas armazenadoras de energia. Essas reações químicas são chamadas de reações endergônicas e não são espontâneas. Uma reação endergônica não ocorrerá sozinha sem a adição de energia livre.

Observe cada um dos processos mostrados e decida se é endergônico ou exergônico.
Há outro conceito importante que deve ser considerado em relação às reações endergônicas e exergônicas. Reações exergônicas requerem uma pequena quantidade de energia para prosseguir, antes que eles possam prosseguir com seus passos de liberação de energia. Estas reações têm uma liberação líquida de energia, mas ainda requerem alguma entrada de energia no começo. Essa pequena quantidade de energia necessária para que todas as reações químicas ocorram é chamada de energia de ativação .
Enzimas
Uma substância que ajuda uma reação química a ocorrer é chamada de catalisador, e as moléculas que catalisam reações bioquímicas são chamadas de enzimas.. A maioria das enzimas são proteínas e executam a tarefa crítica de diminuir as energias de ativação de reações químicas dentro da célula.
A maioria das reações críticas a uma célula viva ocorre muito lentamente a temperaturas normais para ser de alguma utilidade para a célula. Sem enzimas para acelerar essas reações, a vida não poderia persistir. As enzimas fazem isso ligando-se às moléculas reagentes e mantendo-as de modo a tornar mais fáceis os processos de quebra e formação de ligações químicas.
É importante lembrar que as enzimas não mudam se a reação é exergônica (espontânea) ou endergônica. Isso ocorre porque eles não alteram a energia livre dos reagentes ou produtos. Eles só reduzir a energia de ativação necessária para a reação de ir para a frente ( figura). Além disso, uma enzima em si é inalterada pela reação que catalisa. Uma vez que uma reação tenha sido catalisada, a enzima é capaz de participar de outras reações.

Os reagentes químicos aos quais uma enzima se liga são chamados de substratos da enzima . Pode haver um ou mais substratos, dependendo da reação química específica. Em algumas reações, um único substrato reagente é dividido em vários produtos.
Em outros, dois substratos podem se unir para criar uma molécula maior. Dois reagentes também podem entrar em uma reação e ambos se modificam, mas deixam a reação como dois produtos. A localização dentro da enzima onde o substrato se liga é chamada de sítio ativo da enzima. O site ativo é onde a “ação” acontece.
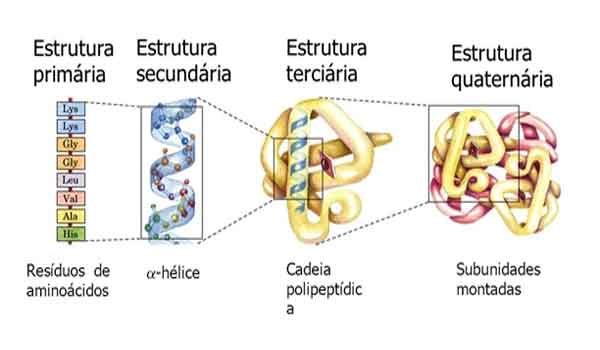
Como as enzimas são proteínas, existe uma combinação única de cadeias laterais de aminoácidos no sítio ativo. Cada cadeia lateral é caracterizada por propriedades diferentes. Eles podem ser grandes ou pequenos, fracamente ácidos ou básicos, hidrofílicos ou hidrofóbicos, carregados positiva ou negativamente, ou neutros. A combinação única de cadeias laterais cria um ambiente químico muito específico dentro do local ativo. Este ambiente específico é adequado para se ligar a um substrato químico específico (ou substratos).
Sites ativos estão sujeitos a influências do ambiente local. Aumentar a temperatura ambiente geralmente aumenta as taxas de reação, catalisadas por enzimas ou outras. Entretanto, temperaturas fora de uma faixa ótima reduzem a taxa na qual uma enzima catalisa uma reação.
Temperaturas quentes eventualmente causarão desnaturação das enzimas, uma mudança irreversível na forma tridimensional e, portanto, a função da enzima. As enzimas também são adequadas para funcionar melhor dentro de um certo pH e faixa de concentração de sal e, como ocorre com a temperatura, o pH extremo e as concentrações de sal podem causar a desnaturação das enzimas.
Por muitos anos, os cientistas pensaram que a ligação enzima-substrato ocorria de uma maneira simples, “fechadura e chave”. Este modelo afirmou que a enzima e o substrato se encaixam perfeitamente em uma etapa instantânea.
No entanto, a pesquisa atual suporta um modelo chamado ajuste induzido ( Figura ). O modelo de ajuste induzido expande o modelo chave-fechadura, descrevendo uma ligação mais dinâmica entre a enzima e o substrato. À medida que a enzima e o substrato se juntam, sua interação causa uma ligeira mudança na estrutura da enzima que forma um arranjo de ligação ideal entre a enzima e o substrato.
Quando uma enzima liga seu substrato, um complexo enzima-substrato é formado. Esse complexo reduz a energia de ativação da reação e promove sua rápida progressão em uma das várias maneiras possíveis. Em um nível básico, as enzimas promovem reações químicas que envolvem mais de um substrato, reunindo os substratos em uma orientação ideal para a reação.
Outra maneira pela qual as enzimas promovem a reação de seus substratos é criar um ambiente ideal dentro do sítio ativo para que a reação ocorra. As propriedades químicas que emergem do arranjo particular dos grupos R de aminoácidos dentro de um sítio ativo criam o ambiente perfeito para os substratos específicos de uma enzima reagirem.
O complexo enzima-substrato também pode diminuir a energia de ativação, comprometendo a estrutura da ligação, de modo que é mais fácil de quebrar. Finalmente, as enzimas também podem diminuir as energias de ativação participando da reação química em si. Nestes casos, é importante lembrar que a enzima sempre retornará ao seu estado original pela conclusão da reação. Uma das propriedades marcantes das enzimas é que elas permanecem inalteradas pelas reações que elas catalisam. Depois que uma enzima catalisa uma reação, ela libera seu (s) produto (s) e pode catalisar uma nova reação.

Seria ideal ter um cenário em que todas as enzimas de um organismo existissem em oferta abundante e funcionassem de maneira ideal sob todas as condições celulares, em todas as células, em todos os momentos. No entanto, uma variedade de mecanismos garante que isso não aconteça. As necessidades e condições celulares variam constantemente de célula para célula e mudam dentro das células individuais ao longo do tempo.
As enzimas necessárias das células do estômago diferem das células de armazenamento de gordura, células da pele, células do sangue e células nervosas. Além disso, uma célula de órgão digestivo trabalha muito mais para processar e quebrar os nutrientes durante o tempo que segue de perto uma refeição em comparação com muitas horas após uma refeição. Como essas demandas e condições celulares variam, o mesmo acontece com as quantidades e a funcionalidade de diferentes enzimas.
Como as taxas de reações bioquímicas são controladas pela energia de ativação e as enzimas são mais baixas e determinam as energias de ativação para reações químicas, as quantidades relativas e o funcionamento da variedade de enzimas em uma célula determinam quais reações irão prosseguir e em quais taxas. Essa determinação é rigidamente controlada nas células. Em certos ambientes celulares, a atividade enzimática é parcialmente controlada por fatores ambientais como pH, temperatura, concentração de sal e, em alguns casos, cofatores ou coenzimas.
As enzimas também podem ser reguladas de maneiras que promovem ou reduzem a atividade enzimática. Existem muitos tipos de moléculas que inibem ou promovem a função enzimática e vários mecanismos pelos quais o fazem.
Em alguns casos de inibição enzimática, uma molécula inibidora é semelhante a um substrato que pode se ligar ao sítio ativo e simplesmente bloquear o substrato da ligação. Quando isso acontece, a enzima é inibida através da inibição competitiva , porque uma molécula inibidora compete com o substrato pela ligação ao sítio ativo.
Por outro lado, na inibição não competitiva , uma molécula inibidora se liga à enzima em um local diferente do sítio ativo, chamado de sítio alostérico, mas ainda consegue bloquear a ligação do substrato ao sítio ativo. Algumas moléculas inibidoras se ligam a enzimas em um local onde sua ligação induz uma mudança conformacional que reduz a afinidade da enzima por seu substrato. Este tipo de inibição é chamado de inibição alostérica ( Figura). A maioria das enzimas reguladas alostericamente é composta de mais de um polipeptídeo, o que significa que eles têm mais de uma subunidade proteica.
Quando um inibidor alostérico se liga a uma região em uma enzima, todos os sítios ativos nas subunidades de proteína são alterados ligeiramente de forma que eles liguem seus substratos com menos eficiência. Existem ativadores alostéricos, bem como inibidores. Ativadores alostéricos ligam-se a locais de uma enzima longe do sítio ativo, induzindo uma mudança conformacional que aumenta a afinidade do (s) sítio (s) ativo (s) da enzima por seu (s) substrato (s) ( Figura ).

Desenvolvedor de Medicamentos Farmacêuticos

As enzimas são componentes fundamentais das vias metabólicas. Entender como as enzimas funcionam e como elas podem ser regulamentadas são os princípios-chave por trás do desenvolvimento de muitos medicamentos farmacêuticos no mercado atualmente. Os biólogos que trabalham neste campo colaboram com outros cientistas para projetar drogas ( Figura ).
Considere estatinas, por exemplo, estatinas é o nome dado a uma classe de drogas que podem reduzir os níveis de colesterol. Estes compostos são inibidores da enzima HMG-CoA redutase, que é a enzima que sintetiza o colesterol a partir de lipídios no corpo.
Ao inibir esta enzima, o nível de colesterol sintetizado no corpo pode ser reduzido. Da mesma forma, o acetaminofeno, popularmente comercializado sob a marca Tylenol, é um inibidor da enzima ciclooxigenase. Embora seja usado para aliviar a febre e a inflamação (dor), seu mecanismo de ação ainda não é completamente compreendido.
Como as drogas são descobertas? Um dos maiores desafios na descoberta de medicamentos é identificar um alvo de drogas. Um alvo de drogas é uma molécula que é literalmente o alvo da droga. No caso das estatinas, a HMG-CoA redutase é o alvo da droga. Alvos de drogas são identificados através de pesquisa meticulosa no laboratório. Identificar o alvo sozinho não é suficiente; os cientistas também precisam saber como o alvo age dentro da célula e quais reações dão errado no caso de doença.
Uma vez que o alvo e o caminho são identificados, o processo real de desenvolvimento de drogas começa. Nesse estágio, químicos e biólogos trabalham juntos para projetar e sintetizar moléculas que possam bloquear ou ativar uma reação em particular. No entanto, este é apenas o começo: se e quando um protótipo de droga for bem sucedido no desempenho de sua função,
Muitas enzimas não funcionam otimamente, ou mesmo de todo, a menos que se liguem a outras moléculas auxiliares não proteicas específicas. Eles podem se ligar temporariamente através de ligações iônicas ou de hidrogênio, ou permanentemente através de ligações covalentes mais fortes.
A ligação a estas moléculas promove a ótima forma e função de suas respectivas enzimas. Dois exemplos destes tipos de moléculas auxiliares são cofatores e coenzimas. Cofactores são íons inorgânicos, como íons de ferro e magnésio. As coenzimas são moléculas auxiliares orgânicas, aquelas com uma estrutura atômica básica composta de carbono e hidrogênio.
Como as enzimas, essas moléculas participam de reações sem serem modificadas e, por fim, são recicladas e reutilizadas. As vitaminas são a fonte de coenzimas. Algumas vitaminas são precursoras de coenzimas e outras agem diretamente como coenzimas.
A vitamina C é uma coenzima direta para múltiplas enzimas que participam na construção do importante tecido conjuntivo, o colágeno. Portanto, a função enzimática é, em parte, regulada pela abundância de vários co-fatores e coenzimas, que podem ser fornecidos pela dieta de um organismo ou, em alguns casos, produzidos pelo organismo.
Inibição do feedback nas vias metabólicas
Moléculas podem regular a função enzimática de várias maneiras. A questão principal permanece, no entanto: quais são essas moléculas e de onde elas vêm? Alguns são cofatores e coenzimas, como você aprendeu. Que outras moléculas na célula fornecem regulação enzimática, como modulação alostérica e inibição competitiva e não competitiva?
Talvez as fontes mais relevantes de moléculas reguladoras, no que diz respeito ao metabolismo celular enzimático, sejam os produtos das próprias reações metabólicas celulares. De uma maneira mais eficiente e elegante, as células evoluíram para usar os produtos de suas próprias reações para inibir a atividade enzimática.
A inibição de feedback envolve o uso de um produto de reação para regular sua própria produção adicional ( Figura). A célula responde a uma abundância dos produtos diminuindo a produção durante reações anabólicas ou catabólicas. Tais produtos de reação podem inibir as enzimas que catalisaram sua produção através dos mecanismos descritos acima.

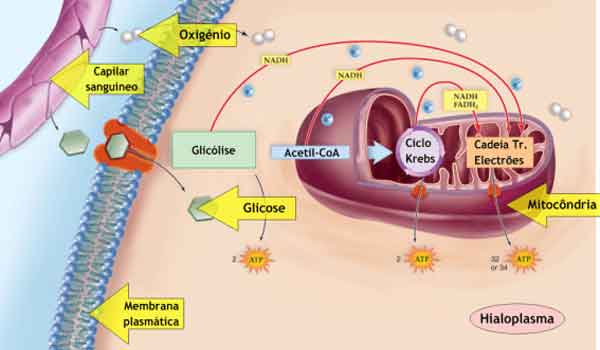
A produção de aminoácidos e nucleotídeos é controlada através da inibição de feedback. Além disso, o ATP é um regulador alostérico de algumas das enzimas envolvidas na quebra catabólica do açúcar, o processo que cria o ATP.
Desta forma, quando o ATP está em abundância, a célula pode impedir a produção de ATP. Por outro lado, o ADP serve como um regulador alostérico positivo (um ativador alostérico) para algumas das mesmas enzimas que são inibidas pelo ATP. Assim, quando os níveis relativos de ADP são altos em comparação com o ATP, a célula é acionada para produzir mais ATP através do catabolismo do açúcar.
Resumo da seção
Células executam as funções da vida através de várias reações químicas. O metabolismo de uma célula se refere à combinação de reações químicas que ocorrem dentro dela. Reações catabólicas dividem substâncias químicas complexas em mais simples e estão associadas à liberação de energia. Processos anabólicos constroem moléculas complexas a partir de moléculas mais simples e requerem energia.
No estudo de energia, o termo sistema refere-se ao assunto e ambiente envolvidos nas transferências de energia. A entropia é uma medida do distúrbio de um sistema. As leis físicas que descrevem a transferência de energia são as leis da termodinâmica. A primeira lei afirma que a quantidade total de energia no universo é constante.
A segunda lei da termodinâmica afirma que toda transferência de energia envolve alguma perda de energia de uma forma inutilizável, como a energia térmica. A energia vem em diferentes formas: cinética, potencial e livre. A mudança na energia livre de uma reação pode ser negativa (libera energia, exergônica) ou positiva (consome energia, endergônica). Todas as reações requerem uma entrada inicial de energia para prosseguir, chamada energia de ativação.
As enzimas são catalisadores químicos que aceleram as reações químicas, diminuindo sua energia de ativação. As enzimas têm um sítio ativo com um ambiente químico único que se ajusta a reagentes químicos específicos para essa enzima, chamados substratos. Pensa-se que as enzimas e substratos se ligam de acordo com um modelo de ajuste induzido. A ação enzimática é regulada para conservar recursos e responder de maneira otimizada ao meio ambiente.
Referências:
Glossário
- energia de ativação
- a quantidade de energia inicial necessária para que as reações ocorram
- Site ativo
- uma região específica na enzima onde o substrato se liga
- inibição alostérica
- o mecanismo para inibir a ação da enzima no qual uma molécula reguladora se liga a um segundo sítio (não o sítio ativo) e inicia uma mudança de conformação no sítio ativo, impedindo a ligação com o substrato
- anabólico
- descreve o caminho que requer uma entrada de energia líquida para sintetizar moléculas complexas das mais simples
- bioenergética
- o conceito de fluxo de energia através de sistemas vivos
- catabólico
- descreve o caminho no qual moléculas complexas são divididas em moléculas mais simples, produzindo energia como um produto adicional da reação
- inibição competitiva
- um mecanismo geral de regulação da atividade enzimática no qual uma molécula diferente do substrato da enzima é capaz de se ligar ao sítio ativo e impedir que o próprio substrato se ligue, inibindo assim a taxa total de reação da enzima
- endergônico
- descreve uma reação química que resulta em produtos que armazenam mais energia potencial química do que os reagentes
- enzima
- uma molécula que catalisa uma reação bioquímica
- exergonic
- descreve uma reação química que resulta em produtos com menos energia potencial química do que os reagentes, além da liberação de energia livre
- inibição de feedback
- um mecanismo de regulação da atividade enzimática no qual o produto de uma reação ou o produto final de uma série de reações seqüenciais inibe uma enzima para uma etapa anterior na série de reações
- energia termica
- a energia transferida de um sistema para outro que não é trabalho
- energia cinética
- o tipo de energia associada a objetos em movimento
- metabolismo
- todas as reações químicas que ocorrem dentro das células, incluindo aquelas que usam energia e aquelas que liberam energia
- inibição não competitiva
- um mecanismo geral de regulao da actividade enzimica, no qual uma molula reguladora se liga a um local diferente do local activo e evita que o local activo se ligue ao substrato; assim, a molécula inibidora não compete com o substrato pelo sítio ativo; inibição alostérica é uma forma de inibição não competitiva
- energia potencial
- o tipo de energia que se refere ao potencial para fazer o trabalho
- substrato
- uma molécula em que a enzima age
- termodinâmica
- a ciência das relações entre calor, energia e trabalho